小分子化合物非竞争性免疫分析的最新进展
发布时间:2024-04-23 09:39:24来源:
本文综述了四种代表性检测小分子化合物的非竞争免疫分析方法:和;概述了小分子化合物非竞争性免疫分析的发展情况;讨论了面临的技术挑战和可能的解决方案;旨在启发小分子化合物免疫分析新方法的开发。
【正文】
开发非竞争性免疫分析
免疫分析由于其灵敏、易用和低成本等特点,被广泛应用于诊断、环境与食品检测。然而小分子化合物无免疫原性且仅有一个表位,其免疫分析常采用灵敏性低、工作范围窄(相对夹心法免疫分析法)的竞争法。改进小分子化合物免疫分析的策略包括:设计半抗原改善免疫原性以制备高亲和力抗体;开发新的信号放大材料或检测模式如:量子点(QDs)、上转换纳米颗粒(UCNPs)、金属有机框架(MOFs)、聚集诱导发光荧光微球(AIEgens)以提高灵敏度;以及以弥补竞争法的不足等。
基于抗独特型抗体的免疫分析、基于抗异型抗体的免疫分析、开放夹心免疫分析
本文聚焦于非竞争性免疫分析的研究进展,介绍了四种具有代表性的非竞争性免疫分析:以及(图1),概述了这些方法在小分子化合物检测领域的前景和挑战。

图1:小分子化合物非竞争性免疫分析发展的时间线。
一、基于抗独特型抗体的免疫分析
根据Jerne的免疫网络理论,抗独特型(anti-idiotype)抗体(Ab2)是识别靶标特异性抗体(Ab1)可变区独特位的抗体,具有免疫调节作用。Ab2包括Ab2α和Ab2β,Ab2β作为抗原内影像,靶向Ab1的抗原识别位点,可以完全阻断抗原与Ab1结合,而Ab2α识别Ab1可变区域的其他表位。由于空间位阻,Ab2α和Ab2β不能同时结合Ab1。
1990年,Barnard和Kohen首次开发出雌二醇的抗独特型免疫分析:当靶标存在时Ab1与铕标Ab2α结合,有信号;靶标不存在时Ab1与Ab2β结合,无信号,该方法LOD低至2 fmol(图2A)。此后,检测黄体酮,去氧胆酸7-N-乙酰氨基葡萄糖苷、11-脱氧皮质醇的抗独特型免疫分析也被陆续报道(图2B)。然而,产生Ab2的杂交瘤很难筛选,阳性克隆率通常低于1%(图2C)。为提高筛选效率,可从噬菌体展示抗体库中筛选重组抗独特型抗体(rAb2),如:单链抗体、纳米抗体(图2D)。
rAb2和Ab1之间的结合价也会影响分析灵敏度。当单价rAb2以两倍于传统mAb2的摩尔速率与mAb1结合时,可能会增强信号强度、提升灵敏度。然而当rAb2体积较小时,空间位阻不足,Ab1可能同时结合rAb2α和rAb2β从而产生错误结果。未来的研究应关注平衡Ab2的大小及其空间位阻的关系,制备相匹配的Ab2和Ab1。
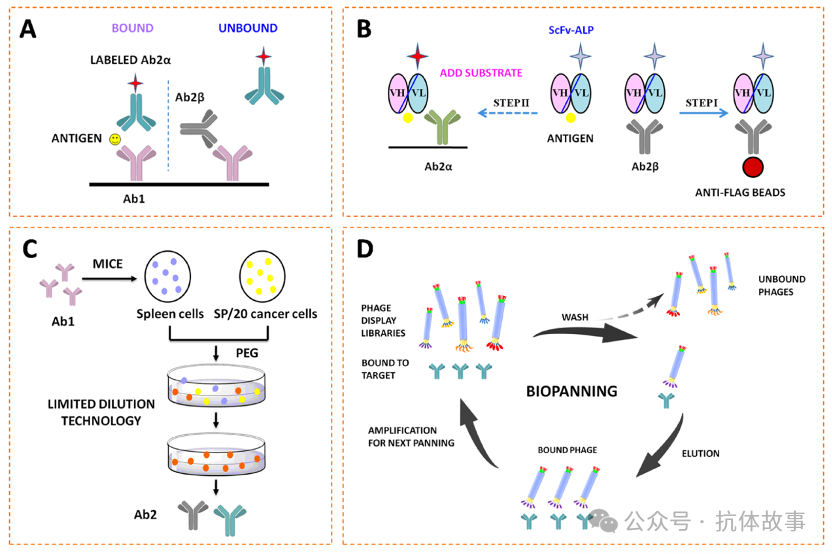
图2:抗独特型免疫分析原理与示例
二、
相比于涉及三种抗体的抗独特型分析,基于抗异型(metatype)抗体的非竞争性免疫分析更简单。靶标和抗体结合形成免疫复合物(IC)后形成的新表位称为异型位点。用免疫复合物作为抗原时,可能会产生仅识别异型位点的抗异型(抗IC)抗体(图3A),进而形成抗体-小分子化合物-抗异型抗体的伪夹心。基于该策略,成功制备了靶向δ9-四氢大麻酚、血管紧张素II和微囊藻毒素的抗IC mAb(图3B)。可以使用各种展示技术更高效地筛选抗IC重组抗体(rAbs)(图3C)。
制备抗IC抗体的关键问题在于抗体(Ab1)与靶标结合后引起构象变化形成新表位,而小分子化合物可能会被埋进mAb1或rAb1的结合口袋,产生非常隐蔽的构象变化。对此,可以用噬菌体展示的7–11随机肽库筛选抗IC肽,较小的体积使其能进入IC的腔或间隙与IC深处的异型位点相互作用从而建立抗IC免疫分析;该方法已被用于检测莠去津、禾草敌。人工合成的抗IC肽有时会丧失亲和力,或者单价合成肽结合相比噬菌体携带的肽亲和力更差,原因可能是噬菌体维持了肽的构象。为解决这一问题,可以将合成肽与一些生物或有机大分子如:链霉亲和素、志贺毒素以及十聚水溶性碳水化合物配体聚合物等进行偶联以产生多价肽,增强亲和力。

图3:抗异型免疫分析原理与示例。
三、开放夹心免疫分析
1996年Ueda发现抗卵溶菌酶抗体的VH和VL之间的相互作用可以被抗原增强导致抗体可变区稳定化,并基于这一现象开发了开放夹心免疫分析(OS-IA)。OS-IA仅使用一种抗体,避免了筛选多种抗体带来的麻烦,已被成功用于玉米赤霉烯酮、苯甲醛、甲状腺激素等小分子化合物的检测。
显然,建立OS-IA的关键在于如何筛选能被待检靶标增强VH和VL互作的抗体。报道的筛选方法包括:基于分裂FV(spFv)的噬菌体筛选系统(图4A)、基于Fab的噬菌体筛选系统(pDong1)(图4B)以及从现有的杂交瘤产生的mAb中进行筛选。可以在框架区引入点突变弱化VH-VL的初始相互作用提高OS-IA的信噪比。
根据是否需要洗涤分离,OS-IA被分为异相检测、均相检测。异相检测常固定VL,再加入靶标和VH形成夹心复合物后检测信号强度(图4C)。报道的异相OS-IA包括:基于噬菌体的OS-ELISA、基于免疫场效应晶体管的OS-FET以及基于反向PCR的OS-IA。

均相检测也被称为开放夹心荧光免疫分析(OS-FIA):将荧光分子分别偶联至VH和VL,靶标驱动VH- VL互作后两个荧光分子彼此接近,导致供体能量降低和受体能量增加并产生信号。被报道的OS-FIA包括:基于荧光素和罗丹明X的OS-FIA、基于突变GFP融合蛋白的OS-FIA以及基于海肾荧光素酶(RLuc)的OS-FIA。酶的寡聚化和蛋白片段互补分析(PCA)也可用于建立OS-IA。如:将β-半乳糖苷酶(β-gal)的两种无活性的突变体δα和δω分别偶联VH、VL,二者接近后形成活性酶(图4D);以及基于纳米荧光酶(NLuc)两个片段的PCA建立OS-IA(图4E)。
图4: OS-IA抗体筛选方法与检测示例。
四、基于淬灭体的免疫分析
将抗体与荧光染料(如TAMRA、R6G和ATTO等)偶联制备的淬灭体(Q-body)也可用于建立均相非竞争性免疫分析。抗原不存在时,染料由于其疏水性靠近抗原结合区的色氨酸(Trp)残基,发生光诱导电子转移(PET),关闭荧光;反之,抗原结合抗体后染料向外移动,阻止PET,打开荧光(图5A)。
不难发现Q-body的作用依赖于抗原与染料的竞争,而抗体的抗原结合区往往位于N端,所以一般将染料标记在抗体N端。报道的标记策略包括:使用无细胞翻译介导的位置特异性标记(图5B)、在轻重链的两个N端都引入染料构建Fab型Q-body、使用琥珀酸(UAG)密码子或四碱基密码子(CGGG)在同一Fab引入两个不同的荧光染料、结合重组抗体的原核表达和巯基马来酰亚胺标记大量制备Q-body(图5C)、基于纳米抗体制备Q-body等。
也可用直接偶联法制备Q-body:如利用Rapoport’s salt在Fab N端特异性引入酮羰基偶联具有氨基或酰肼基的荧光染料、用吲哚-3-丁酸偶联的荧光素与抗体核苷酸结合位点(NBS)进行紫外光化学交联构建scFv型Q-body、使用还原性烷基化反应选择性标记抗体的N端α-氨基制备基于单抗或多抗的Q-body、基于卷曲螺旋寡聚化结构域快速制备卷曲Q-body、用金黄色葡萄球菌分选酶A(SrtA 7+)的突变体实现Q-body的多种荧光偶联策略等。

由于结构、Trp残基分布各异,不是所有抗体都能制备Q-body,所以Q-body的开发要进行大量筛选实验,因此提高抗体筛选效率对Q- body的开发至关重要。提高筛选效率的尝试包括:用蛋白M(PM)制成的抗体结合淬灭探针将Fab或IgG抗体转化为Q-body(图5D)、用来自人支原体的PM Q探针筛选Q-body的原型抗体、基于酵母展示和E4/K4-标签相互作用筛选Q-body的原型抗体、基于结构分析设计和靶向修饰现有抗体设计Q-body绕过复杂的筛选程序。
图5: Q-body免疫分析的原理、荧光染料标记方法与抗体筛选策略。
结论与展望
本文综述了四种用于小分子快速检测的非竞争性免疫分析方法。上述研究表明非竞争性免疫分析在小分子检测方面既具有巨大的潜力也面临着诸多挑战。非竞争法所用的抗体可以通过动物免疫或展示技术制备,然而展示技术的局限性在于成本较高、库容有限、谱系信息与亲和力提升的可能性受损(与动物免疫相比),因此未来的研究方向可能是结合动物免疫和体外展示技术的优势来改善抗体发现过程,同时为机器学习提供数据集。将新型材料如:MOF、分子印迹复合物、共价-有机框架、碳基材料、硅基材料、聚多巴胺衍生材料,用于前处理可以提高检测的灵敏度和准确性;将其与非竞争性免疫分析结合是小分子快速检测的一个重要发展方向。将所有反应步骤集成到微流控芯片的芯片实验室(LOC),有试剂消耗少、检测速度快、便携和能检测护理点等优点,也为非竞争性免疫分析开辟了新的可能性。
【原文出处】
Liang, Y.-F.; Yang, J.-Y.; Shen, Y.-D.; Xu, Z.-L.; Wang, H. A Breakthrough of Immunoassay Format for Hapten: Recent Insights into Noncompetitive Immunoassays to Detect Small Molecules.Crit. Rev. Food Sci. Nutr.2024, 1–11.
指导教师:王战辉



